Chlorate
Elektrolytische Chlorat-Herstellung und Umfällen zu Kaliumchlorat
Elektrolytische Chlorat-Herstellung und Umfällen zu Kaliumchlorat
Chlorate sind ein sehr starkes Oxidationsmittel und ergeben sehr viel empfindlichere Mischungen als die meisten anderen in der
Pyrotechnik gebräuchlichen Oxidationsmittel. Dies gilt nicht nur für mechanische Belastung; auch die Gefahr durch Imkompatibilitäten ist bei Chloraten sehr groß
(z.B. darf Chlorat niemals mit Schwefel, Schwefelverbindungen, Phsophor, säurehaltigen Stoffen oder Ammoniumverbindungen in Kontakt gebracht werden)!
Heutzutage können Chloratmischungen durch ungefährlichere Mischungen ersetzt werden; daher sind Chlorate in der Pyrotechnik zu vermeiden! Auch bei der elektrolytischen Perchlorat-Herstellung stellen Chlorat-Verunreinigungen aus der Elektrolyse eine Gefahrenquelle dar!
Heutzutage können Chloratmischungen durch ungefährlichere Mischungen ersetzt werden; daher sind Chlorate in der Pyrotechnik zu vermeiden! Auch bei der elektrolytischen Perchlorat-Herstellung stellen Chlorat-Verunreinigungen aus der Elektrolyse eine Gefahrenquelle dar!
Warnung:
Verbrauchsmaterialien:
Werkzeuge etc.:
The Pyrotechnician weist darauf hin, dass in Deutschland
die Herstellung von pyrotechnischen Mischungen ausserhalb von zugelassenen Firmen verboten ist.
- Natriumchlorid (Kochsalz)
- Kaliumnitrat oder Kaliumchlorid oder Kaliumcarbonat
- demineralisiertes Wasser
- Graphitelektrode
- Edelstahlelektrode
- etwas Kabel
- Tesa-Film
- Isolierband
- 1l-Plastikbehälter mit Deckel
- Computer-Netzteil
- alter Kochtopf
- Stoffstück, z.B. altes T-Shirt
- Messbecher
- Flache Schüssel o.ä. zum Trocknen
- (Thermometer)
Elektrolyse:
Zuerst einige Worte zu den benötigten Materialien, insbesondere zu den Elektroden. Das Kathodenmaterial kann relativ beliebig gewählt werden. Ein alter Imbusschlüssel, ein alter Löffel oder
was euch sonst in die Hände fällt - ideal ist Edelstahl, notfalls tut es aber auch ein Stück einer Blechdose. Außerdem sollten die Elektroden möglichst groß sein, da die erzielbare Stromstärke von der Elektrodenoberfläche abhängt.
Kritischer ist die Auswahl des Anodenmaterials. Metalle sind praktisch untauglich, da sie sich in kürzester Zeit auflösen und dabei den Elektrolyten verunreinigen. Die einzige ungefährliche und günstige Möglichkeit sind Graphitelektroden, die jedoch schlecht für die Perchlorat-Herstellung geeignet sind und vor allem relativ schnell erodieren.
Alternativen sind Bleidioxid-Elektroden, die jedoch selbst mit giftigen Bleisalzen hergestellt werden müssen, oder auch Platinelektroden, die jedoch sehr teuer sind. Weitere mögliche Materialien werden auf den unten verlinkten Seiten aufgeführt.
Kritischer ist die Auswahl des Anodenmaterials. Metalle sind praktisch untauglich, da sie sich in kürzester Zeit auflösen und dabei den Elektrolyten verunreinigen. Die einzige ungefährliche und günstige Möglichkeit sind Graphitelektroden, die jedoch schlecht für die Perchlorat-Herstellung geeignet sind und vor allem relativ schnell erodieren.
Alternativen sind Bleidioxid-Elektroden, die jedoch selbst mit giftigen Bleisalzen hergestellt werden müssen, oder auch Platinelektroden, die jedoch sehr teuer sind. Weitere mögliche Materialien werden auf den unten verlinkten Seiten aufgeführt.

Als Netzteil sind alte Computer-Netzteile gut geeignet. Diese liefern auf der 5V-Leitung teilweise deutlich über 20A - bei Elektrolysen ist eine hohe Stromstärke besonders wichtig, um vernünftige Laufzeiten zu erreichen.
Bei ATX-Netzteilen muss zum Betrieb am Hauptstecker zwischen der grünen Leitung und einer beliebigen schwarzen Leitung entweder eine Drahtbrücke in den Stecker gesteckt werden oder zwei Leitungen müssen fest verbunden werden.
Nur so läuft das ATX-Netzteil an. Dann kann an jeder beliebigen Leitung ein rotes (d.i. die 5V-Leitung) mit einem schwarzen Kabel (Masse) als Anschluss für die Elektrolyse verwendet werden.
Mit einem Stromkostenmessgerät lässt sich gut die Laufzeit überwachen: Bei einer normalen Zelle (Wirkungsgrad ca. 50%) werden für 500g NaCl ca. 15KWh verbraucht.
Mit einem Stromkostenmessgerät lässt sich gut die Laufzeit überwachen: Bei einer normalen Zelle (Wirkungsgrad ca. 50%) werden für 500g NaCl ca. 15KWh verbraucht.


Nun kann die Elektrolyselösung angesetzt werden. Dazu werden ca. 320g Natriumchlorid, d.i. Kochsalz, möglichst nicht fluoridiert und iodiert, in einem Liter demineralisiertem Wasser gelöst.
Diese Lösung wird nun in den Plastikbehälter für die Elektrolyse gegeben. In den Deckel werden zwei Löcher für die Elektroden gemacht und evtl. ein weiteres für Thermometer, zum Wasser nachfüllen etc.
Nun werden die Elektroden durch die Löcher gesteckt. Idealerweise beträgt der Abstand zwischen 5mm und 10mm und die Elektroden sind so angeordnet, dass am Graphit gebildetes Gas erst an die andere Elektrode steigt, bevor es die Lösung verlässt.
Letzteres ist nicht unbedingt notwendig, aber erhöht die Effizienz der Elektrolysezelle
Nun werden an den Elektroden die Anschlusskabel befestigt. Dazu reicht es, diese abzuisolieren und mit Tesa-Film an die Elektroden zu kleben. Dabei sollten die Anschlusskabel selbst nicht in die Lösung tauchen; Insbesondere Kupferkabel nicht, da bei der Elektrolyse in Lösung gehende Kupferionen die Empfindlichkeit des Chlorats stark erhöhen. Wichtig ist der richtige Anschluss der Kabel: Das rote Kabel (+) wird an die Graphit-Elektrode geschlossen (die damit zur Anode wird), das andere Kabel an die Edelstahlkathode.
Nun werden an den Elektroden die Anschlusskabel befestigt. Dazu reicht es, diese abzuisolieren und mit Tesa-Film an die Elektroden zu kleben. Dabei sollten die Anschlusskabel selbst nicht in die Lösung tauchen; Insbesondere Kupferkabel nicht, da bei der Elektrolyse in Lösung gehende Kupferionen die Empfindlichkeit des Chlorats stark erhöhen. Wichtig ist der richtige Anschluss der Kabel: Das rote Kabel (+) wird an die Graphit-Elektrode geschlossen (die damit zur Anode wird), das andere Kabel an die Edelstahlkathode.
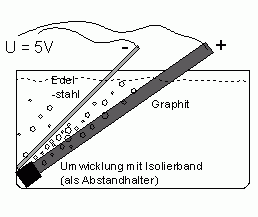
Nun sollte ein Platz gesucht werden, wo die Elektrolyse kontinuierlich laufen kann und etwas Chlor-Geruch nicht stört, z.B. eine Garage. Im Freien muss auf den Schutz besonders des Netzteils vor Regen etc. geachtet werden.
Dann kann das Netzteil angeschalten werden und die Elektrolyse läuft nun. An den Elektroden sollten nun Gasbläschen entstehen; die Lösung erwärmt sich mit der Zeit.
Bei höherer Temperatur ist die Effizienz der Zelle höher, allerdings auch die Erosion des Graphits. Wenn der Verlust an Elektrodenmaterial nicht stört, kann die Temperatur jedoch (evtl. durch zusätzliche Isolierung der Zelle) bis auf 80°C gesteigert werden.
Nun kommt der wichtigste Punkt: Geduld. Bei den hier verwendeten Mengen sind Laufzeiten im Bereich von ca. 2 Wochen normal. Sinkt der Wasserspiegel ab, so sollte mit gesättigter NaCl-Lösung aufgefüllt werden, wobei die entsprechende Mehrmenge bei der Laufzeit zu berücksichtigen ist. Außerdem müssen evtl. die Anschlusskabel gelegentlich erneuert werden, wenn der Kontakt schlechter wird (am Stromfluss erkennbar).
Nun kommt der wichtigste Punkt: Geduld. Bei den hier verwendeten Mengen sind Laufzeiten im Bereich von ca. 2 Wochen normal. Sinkt der Wasserspiegel ab, so sollte mit gesättigter NaCl-Lösung aufgefüllt werden, wobei die entsprechende Mehrmenge bei der Laufzeit zu berücksichtigen ist. Außerdem müssen evtl. die Anschlusskabel gelegentlich erneuert werden, wenn der Kontakt schlechter wird (am Stromfluss erkennbar).

Aufbereitung und Reinigung:
Nach erfolgreicher Elektrolyse muss das Produkt in eine für pyrotechnische Zwecke geeignete Form gebracht werden.
D.h. idealerweise wird das gebildete Chlorat als Kaliumchlorat ausgefällt und evtl. nochmals umgefällt, um Verunreinigungen loszuwerden.
Zuerst wird die Lösung z.B. mit einem Kaffeefilter oder einem Stück Stoff einmal vorgefiltert; dadurch werden Schwebstoffe wie z.B. Elektrodenabtrag entfernt. Dabei sollten keine Kristalle im Filter zurückbleiben, diese sollten aufgelöst und der Lösung hinzugefügt werden. Idealerweise liegt nun eine klare Lösung vor. Diese wird nun in einem Topf auf ca. 350ml eingekocht, was mit dem Metallmessbecher geprüft wird.
Zuerst wird die Lösung z.B. mit einem Kaffeefilter oder einem Stück Stoff einmal vorgefiltert; dadurch werden Schwebstoffe wie z.B. Elektrodenabtrag entfernt. Dabei sollten keine Kristalle im Filter zurückbleiben, diese sollten aufgelöst und der Lösung hinzugefügt werden. Idealerweise liegt nun eine klare Lösung vor. Diese wird nun in einem Topf auf ca. 350ml eingekocht, was mit dem Metallmessbecher geprüft wird.

Gleichzeitig wird in einem zweiten Topf eine kochende Lösung von Kaliumnitrat (560g in ca. 400ml demin. Wasser) oder Kaliumchlorid (410g in ca. 400ml Wasser) hergestellt.
Hat sich das Kaliumsalz vollständig gelöst und ist die Chlorat-Lösung auf das gewünschte Volumen eingedampft,
so werden beide Lösungen einfach zusammengegeben. Es fällt etwas Kaliumchlorat aus. Beim Abkühlen fällt weiteres Kaliumchlorat aus; ist der Topf auf Raumtemperatur abgekühlt,
so kann weiter auf 0°C gekühlt werden, um maximale Ausbeute zu erhalten. Die kalte Lösung wird dann durch ein Stofftuch, z.B. ein altes T-Shirt wieder filtriert; die zurückbleibenden Kristalle werden
kurz ausgepresst und dann zum Trocknen in ein Gefäß gegegeben (Kaffeefilter tun's natürlich auch statt Stoff).
Die übrige Lösung enthält bei Verwendung von Kaliumnitrat nun verunreinigtes Natriumnitrat. Diese kann eingedampft werden und z.B. in Leuchtsätzen Einsatz finden. Vorsicht aber wegen noch vorhandener Chloratverunreinigungen, insbesondere nicht in Schwefel-haltigen Mischungen verwenden! Bei Verwendung von Kaliumchlorid ist die übrige Lösung wertlos und kann entsorgt werden.
Die übrige Lösung enthält bei Verwendung von Kaliumnitrat nun verunreinigtes Natriumnitrat. Diese kann eingedampft werden und z.B. in Leuchtsätzen Einsatz finden. Vorsicht aber wegen noch vorhandener Chloratverunreinigungen, insbesondere nicht in Schwefel-haltigen Mischungen verwenden! Bei Verwendung von Kaliumchlorid ist die übrige Lösung wertlos und kann entsorgt werden.

Bei längeren Laufzeiten, d.i. für 500g Natriumchlorid mehr als 20KWh wird das Chlorat weiter zu Perchlorat umgesetzt.
Allerdings tritt hierbei verstärkte Graphiterosion auf, und die Effizienz dieser Reaktion ist deutlich geringer.
Dafür ist Perchlorat ein wesentlich sichereres Oxidationsmittel, sofern im Anschluss an die Herstellung eine sorgfältige Entfernung von Chlorat-Verunreinigungen durchgeführt wird. Die Ausfällung erfolgt wieder analog mit einem Kaliumsalz, wobei auf Grund der sehr geringen Löslichkeit des Kaliumperchlorats dieses fast vollständig ausfällt. Außerdem sind die theoretisch erreichbaren Mengen auf Grund der höheren molaren Masse von Kaliumperchlorat größer.
Perchlorat kann auch schneller hergestellt werden, indem von Anfang an Natriumchlorat statt Natriumchlorid elektrolysiert wird, z.B. aus Unkraut-Ex (welches in Deutschland allerdings nicht erhältlich ist, evtl. aber in Frankreich als "Chlorate de Soude" oder "Deshérbant totale" in großen Supermärkten).
Dafür ist Perchlorat ein wesentlich sichereres Oxidationsmittel, sofern im Anschluss an die Herstellung eine sorgfältige Entfernung von Chlorat-Verunreinigungen durchgeführt wird. Die Ausfällung erfolgt wieder analog mit einem Kaliumsalz, wobei auf Grund der sehr geringen Löslichkeit des Kaliumperchlorats dieses fast vollständig ausfällt. Außerdem sind die theoretisch erreichbaren Mengen auf Grund der höheren molaren Masse von Kaliumperchlorat größer.
Perchlorat kann auch schneller hergestellt werden, indem von Anfang an Natriumchlorat statt Natriumchlorid elektrolysiert wird, z.B. aus Unkraut-Ex (welches in Deutschland allerdings nicht erhältlich ist, evtl. aber in Frankreich als "Chlorate de Soude" oder "Deshérbant totale" in großen Supermärkten).

Analyse der Produkte:
Qualitative und Quantitative Analyse des produktes, bzw. der Zellenlösung während dem lauf.

Weiterführende Links und Dokumente:
Webseiten zur Chlorat-Herstellung:
- Frogfot's Page
- yarchive.net
- CapeCanaveral
- Wouter's pyrotechnics page
- alany's page
- Das ehemalige http://chlorate.cjb.net
- The Chlorates and Perchlorates
- "Tried and True Method" zur Perchloratherstellung (txt)
- A. Legendre: Herstellung von Perchloraten durch Elektrolyse (pdf, 433kB)
- Die Herstellung der Chlorate (pdf, 944kB)
- Mathematisches Modell einer Chlorat-Zelle (pdf, 696kB)

www.ThePyrotechnician.com
Copyright © 2002-2019 by Valec





