Flammfärbung
Physikalischer Hintergrund der Emmision von farbigem Licht
Physikalischer Hintergrund der Emmision von farbigem Licht
Grundlagen:
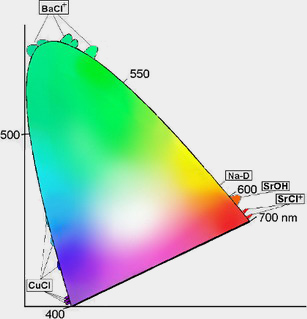
Für unser Farbsehen ist ein relativ geringer Teil des Spektrums der elektromagnetischen Strahlung verantwortlich: das sogenannte sichtbare Licht.
Dabei handelt es sich um Strahlung der Wellenlängen 780nm (rotes Licht) bis 380nm (violett). Das violette Licht ist dabei das energiereichste, das rote
das energieärmste. Im Wellenlängenbereich dazwischen liegen die anderen Farben, so wie sie am Regenbogen sichtbar sind. Dieser Verlauf ist entlang der geschwungenen Linie im Diagramm rechts dargestellt.
Im Diagramm ist ein weiterer wichtiger Punkt für die Farbentstehung des Feuerwerks dargestellt: die Entstehung neuer Farben durch Überlagerung einiger weniger Grundfarben. So entsteht z.B. aus einer Überlagerung von rotem und blauem Licht ein violetter Farbton. Dies ist im Diagramm zu finden, wenn man vom reinen Blau zum reinen Rot eine Verbindunglinie zieht: Auf dieser finden sich die durch Mischung der beiden Ausgangsfarben erzeugbaren Farben. Je nach Rot- und Blauanteil entlang der Linie verschoben ergeben sich die verschiedenen Abstufungen beim Mischen.
Weißes Licht stellt eine Mischung aller sichtbaren Lichtwellenlängen dar.
Im Diagramm ist ein weiterer wichtiger Punkt für die Farbentstehung des Feuerwerks dargestellt: die Entstehung neuer Farben durch Überlagerung einiger weniger Grundfarben. So entsteht z.B. aus einer Überlagerung von rotem und blauem Licht ein violetter Farbton. Dies ist im Diagramm zu finden, wenn man vom reinen Blau zum reinen Rot eine Verbindunglinie zieht: Auf dieser finden sich die durch Mischung der beiden Ausgangsfarben erzeugbaren Farben. Je nach Rot- und Blauanteil entlang der Linie verschoben ergeben sich die verschiedenen Abstufungen beim Mischen.
Weißes Licht stellt eine Mischung aller sichtbaren Lichtwellenlängen dar.
In der Pyrotechnik wird das farbige Licht durch die Anregung von Atomen in der Flamme erzeugt. Dabei erzeugen verschiedene Elemente verschiedene Farben.
So sendet z.B. Natrium in der Flamme gelbes Licht aus. Dies bemerkt man schon, wenn man einfach einige Kochsalzkörner (Natriumchlorid) in eine Spiritusflamme wirft.
Rechts sind die Färbungen verschiedener Elemente dargestellt: von links nach rechts: Lithium, Strontium, Natrium, Kupfer.
Die Wellenlängen für diese Elemente sind im obigen Diagramm am Rand der farbigen Fläche eingezeichnet.
Die Wellenlängen für diese Elemente sind im obigen Diagramm am Rand der farbigen Fläche eingezeichnet.

Lichtemmision im Atommodell:
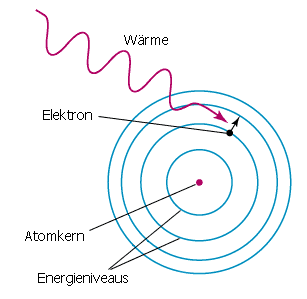
Im vereinfachten Atommodell bestehen Atome aus einem positiv geladenen Kern (Protonen, die durch Neutronen "verklebt" sind) und aus negativ geladenen Elektronen, die
sich auf verschiedenen Energieniveaus um den Kern befinden. Dabei gilt: Je weiter außen, desto mehr Energie hat das Elektron dort.
Außerdem ist zu beachten, dass diese Niveaus nicht stufenlos vorliegen, sondern nur ganz bestimmte, feste Energieniveaus möglich sind.
Durch Energiezufuhr z.B. in Form von Wärme können Elektronen nun aus einem weiter innen liegenden Niveau auf ein weiter außen liegendes übergehen. Man spricht dann von Absorption. Auf diesem Niveau kann das Elektron nun für variierbare Zeit verweilen.
Durch Energiezufuhr z.B. in Form von Wärme können Elektronen nun aus einem weiter innen liegenden Niveau auf ein weiter außen liegendes übergehen. Man spricht dann von Absorption. Auf diesem Niveau kann das Elektron nun für variierbare Zeit verweilen.
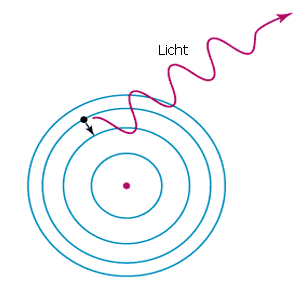
Nach kurzer Zeit fallen nun Elektronen wieder von ihrem höheren Energieniveau zurück. Dabei müssen sie die Energiedifferenz, die sie anfangs aufnahmen um überspringen zu können, wieder abgeben.
Dies geschieht nun zu einem Teil in Form von Licht. Durch die Energiedifferenz der Niveaus ist dabei genau die Wellenlänge des abgegebenen Lichts bestimmt.
Dieser Vorgang der Lichtabgabe wird Emmision genannt.
Für die Pyrotechnik sind jedoch nur sehr wenige Elemente von Bedeutung, da die meisten in Bereichen Licht emmitieren, die für unser Auge nicht sichtbar sind, z.B. Infrarot. Reichen die Farben die durch die Energieniveaus der gebräuchlichen Farbgeber erzielbar sind nicht aus, so müssen wie am Anfang beschrieben Farbgeber unterschiedlicher Farben eingemischt werden um eine entsprechende Mischfarbe zu erhalten.
Für die Pyrotechnik sind jedoch nur sehr wenige Elemente von Bedeutung, da die meisten in Bereichen Licht emmitieren, die für unser Auge nicht sichtbar sind, z.B. Infrarot. Reichen die Farben die durch die Energieniveaus der gebräuchlichen Farbgeber erzielbar sind nicht aus, so müssen wie am Anfang beschrieben Farbgeber unterschiedlicher Farben eingemischt werden um eine entsprechende Mischfarbe zu erhalten.
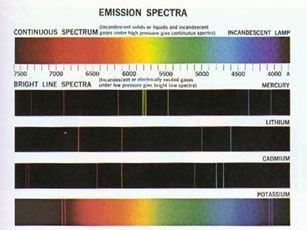
Spektren:
Lässt man weißes Licht durch ein Prisma fallen, wird es ähnlich wie am Regenbogen in die Farben aufgespalten, aus denen es zusammengesetzt ist. Die Ursache dafür ist, dass das Licht unterschiedlicher Wellenlängen beim Durchgang unterschiedlich stark
abgelenkt wird. Nimmt man das so entstandene Spektrum auf, so erhält man ein Bild wie die erste Zeile im Bild rechts (durch Klick vergrößerbar). Alle Wellenlängen- und damit Farbanteile sind gleichermaßen vertreten.
Für farbiges Licht, wie es von pyrotechnischen Flammen abgegeben wird, erhält man Aufnahmen wie die darunter. Dabei entsprechen die Streifen jeweils einer bestimmten Wellenlänge und damit einem bestimmten, für ein Element charakteristischen Elektronenübergang in dessen Schale.
So erkennt man z.B. bei Natrium (engl. Sodium) die Linien, die die gelbe Flammfärbung durch Natrium ausmachen.
Für farbiges Licht, wie es von pyrotechnischen Flammen abgegeben wird, erhält man Aufnahmen wie die darunter. Dabei entsprechen die Streifen jeweils einer bestimmten Wellenlänge und damit einem bestimmten, für ein Element charakteristischen Elektronenübergang in dessen Schale.
So erkennt man z.B. bei Natrium (engl. Sodium) die Linien, die die gelbe Flammfärbung durch Natrium ausmachen.
Farberzeugung in der Praxis:
Bei der praktischen Verwendung fällt auf, dass einfaches Zugeben beliebiger Metallsalze, z.B. der Carbonate, nicht die gewünschte kräftige Farbe bringt.
Um die Färbung zu verbessern, werden daher oft Kunststoffe (PVC, Parlon) oder Oxidationsmittel verwendet, die bei der Verbrennung Chlorwasserstoff oder Chlorionen abgeben (z.B. Kaliumchlorat, Ammoniumperchlorat).
Bei der Verbrennung bilden sich dann Chloride mit den Metallionen, die relativ leicht flüchtig sind und so besonders brillante Färbungen ergeben.
Vor allem Blau gilt als sehr schwierige Farbe, da Kupfer unter den meisten Bedingungen eher grünlich färbt und das gut blau färbende Kupfer(I)-chlorid bei hohen Temperaturen nicht stabil ist. Daher werden hier meist recht kühl brennende Mischungen ohne Metallpulver mit entsprechend starken Oxidationsmitteln eingesetzt. (Andere blaufärbende Elemente und ihre Verbindungen sind oft giftig, teuer oder wegen Inkompatibilitäten für den pyrotechnischen Einsatz nicht geeignet.)
Dass die Chloride nicht einfach direkt zugegeben werden, hängt damit zusammen, dass diese einerseits oft hygroskopisch sind, d.h. wasseranziehend, was den pyrotechnischen Mischungen schadet, und andererseits, dass die Chloride teilweise chemisch nicht stabil genug sind.
Vor allem Blau gilt als sehr schwierige Farbe, da Kupfer unter den meisten Bedingungen eher grünlich färbt und das gut blau färbende Kupfer(I)-chlorid bei hohen Temperaturen nicht stabil ist. Daher werden hier meist recht kühl brennende Mischungen ohne Metallpulver mit entsprechend starken Oxidationsmitteln eingesetzt. (Andere blaufärbende Elemente und ihre Verbindungen sind oft giftig, teuer oder wegen Inkompatibilitäten für den pyrotechnischen Einsatz nicht geeignet.)
Dass die Chloride nicht einfach direkt zugegeben werden, hängt damit zusammen, dass diese einerseits oft hygroskopisch sind, d.h. wasseranziehend, was den pyrotechnischen Mischungen schadet, und andererseits, dass die Chloride teilweise chemisch nicht stabil genug sind.

www.ThePyrotechnician.com
Copyright © 2002-2019 by Valec